In situ hybridization(ISH)のアプリケーションはこれまで短命で非特異的な同位体方法だったのが、特定で長寿命、多色FISHへと進化してきました。オプティクス、干渉フィルター技術、顕微鏡、カメラ、ソフトウエアによるデータ取り扱いの改善などで比較的安価なFISHセットアップが可能になり、多くの研究者の方々に手が届くようになりました。mFISH(マルチプレックス-FISH)のアプリケーションと 最新のデジタル顕微鏡を組み合わせることで、染色体や遺伝子の非同位体検出や複数の核酸配列の分析能力が大幅に改善されました。
干渉フィルターと蛍光イメージング
倒立顕微鏡は、蛍光光源があり、その後エピ蛍光パス(光源以下)が試料へと続きます。パス長には画像化した試料の明るさとコントラストを劇的に改善することに役立つダイクロイックミラー、エキサイタ、エミッタを含むフィルターブロックがあります。図1は倒立顕微鏡での蛍光照明の基本セットアップを説明しています。
 Flgure 1
Flgure 1
Episcopic(照射反射)パスでの基本コンポーネントは光源(ここでは水銀ランプ)、フィルターへとビームが伝播する時に光を集光し光収差を補正するレンズ群、試料に対して適切かつ均一な照射を設定する絞り、フィルターセットを収めるフィルタータレットから構成されます。この構成図では光源のブロードバンドな光が、タレット内で選択的にフィルターがかかり、エキサイタで緑色成分のみ透過し試料へとダイクロイックミラーで反射されるかが模式的にみることができます。その後、赤色蛍光発光が対物レンズ、ミラー、エミッタを通って戻り目やカメラで視覚化されます。フィルターキューブの拡張図を図2に示します。典型的なテキサスレッドセットのエキサイタが黄色、エミッタが赤で示されています。
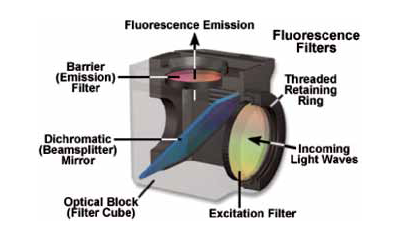 Flgure 2
Flgure 2
光学干渉フィルターの詳細
バンドパスフィルターの仕様付けの方法は何とおりかあります。最も多いものは中心波長(CWL)と半値全幅(FWHM)で、もしくは基準となるカットオン、カットオフ波長での分類です。前者では、図2のエキサイタは580AF20と表記され、基準となるCWLが580nmでFWHMが20nmです。最大半量はフィルターの最大値の50%に達したところでの透過率を取ります(図3)。 後者では、フィルターはカットオン570nmとカットオフ590nmのように表され, CWLは出てきません。カットオンは波長の増加軸に沿ってフィルターの減衰から透過への遷移を表します。カットオフは透過から減衰への遷移を表します。両方の値とも最大透過の50%地点を示します。
カットオンとカットオフの値はロングパスフィルター(図4)とショートパスフィルター(図5)として知られるタイプのフィルターを表すことに使います。ロングパスフィルターは特定のスペクトル範囲内で光を反射または吸収し、カットオン値(ここでは570nm)で透過に移行し、それ以上の波長を広範囲で透過するようにデザインされています。ショートパスフィルターはこの逆で、カットオフよりも長い波長を特定の距離ブロックし、それよりも短い波長を透過します。この反射、透過範囲は無限に継続するわけではなく、コーティング材の特性、コーティングデザイン、光の物理的特性などによって制限されます。
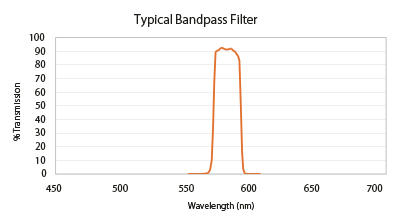 Flgure 3
Flgure 3
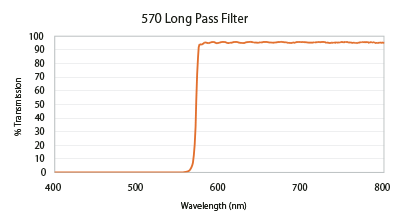 Flgure 4
Flgure 4
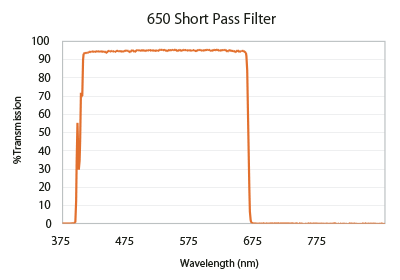 Flgure 5
Flgure 5
FISH、M-FISH専用フィルター
複数の蛍光プローブのイメージングには顕微鏡タロット内のフィルターブロックのセットアップに対しても特別な考慮をする必要があります。1つの方法は試料で各プローブに対して個々のフィルタキューブを使うことです。これは6色視覚化(多くの倒立顕微鏡で標準となるフィルター数は6個です)に有効ですが、それぞれのプローブに対しては慎重にフィルターデザインをする必要があります。このセットアップでは一度に1つだけ蛍光試料を照射すること によってプローブのブリーチングを軽減することができます。このセットアップの難点はフィルターのミスアライメントによってフィルターキューブの切り替えをおこなう際におこる小さなビーム拡散によって起こる画像レジストレーションシフトです。ダイクロイックミラーとエミッタはこの効果に影響するフィルターのコンポーネントです。
もう1つの方式はマルチバンドダイクロイックミラー 一枚と複数エミッタとエキサイタ外部スライダかフィルターホイールに入れて使う方法です。これは画像レジストレーションを維持し機械的振動を軽減しますが、蛍光の明るさが減少し、いくつの異なるプローブを分離できるかが制限され、カラーCCDカメラで要求されるダイナミックレンジと感度が減少することが欠点となります。
蛍光顕微鏡は通常DAPI染色、FITC、TRITC、Texas Redなどの蛍光試薬用のフィルターセットが使えるように付属しています。スタンダードフィルターセットは最大の明るさを得るためにワイドバンドのエキサイタ、エミッタ(ロングパスエミッタの場合もあります)を通常持っています。FISHの場合、このスタンダードセットは2、3、4色ラベルに使えますが、迅速な光学ブリードスルーが問題となります。例えば、FITCはCy3フィルターを通して部分的のみ視覚化できますが、Cy3.5はCy5フィルター2を通して見えます。図6は5種にラベルされた染色体のペアで、チャネル間のクロストークは上中央と左下画像にある矢印で示されています。
下のパネルは一連の擬似カラー画像を重ね合わせたものです。
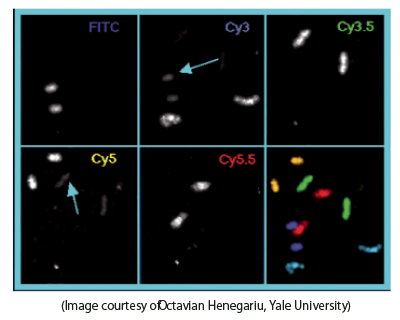 Flgure 6
Flgure 6
マルチカラーラベルで非常に近隣した蛍光試薬同士での光ブリードスルーを最小化させるためには狭帯域バンド幅のフィルターセットが必要です。mFISHでは、必要とされる光分解能と感度を満たす特性のバンド幅10-20nmのエキサイタと20-40nmのエミッタが使用されました。図7は典型的なFITCフィルターセットをFITCとCY3の励起と発光ピークに重ね合わせたものです。
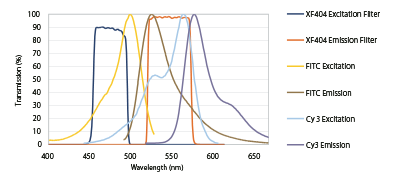 Flgure 7
Flgure 7
フィルターは吸収と発光カーブのかなりの部分をカバーするように デザインされていますが、Cy3の励起と発光両方に重なり合ってしまう部分があり、FITCチャネルがCy3によって邪魔されてしまいます。この解決法は図8に示されるように、Cy3からFITCの光学分可能を改善するために励起と発光バンドが狭められました。エミッタの赤色エッジを制限することで、Cy3の発光カーブでこの範囲は4倍程度減少しました。狭帯域、シャープなエッジのデザインにより、蛍光試薬間で光学ブリードスルーを追加するコストをかけずに複数蛍光プローブを追加するための光学ウインドが広がりました。
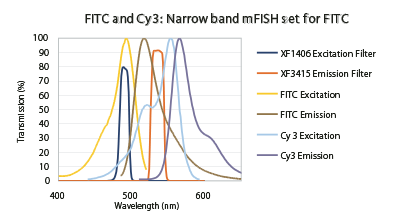 Flgure 8
Flgure 8
300nm以下の光学ウインド内で3つの蛍光試薬が効率的に分離されていることが図9に示されています。この場合、570-620nm範囲でCy3.5などを4つめの蛍光試薬として簡単に組み合わせる こともできますが、ここでは省略されました。
mFISHに必要なフィルターの需要は各mFISH蛍光試薬の使えるバンド幅を最適に使うために一緒に合った製品の特定分野を供給することが必要となります。mFISHでよく使用される蛍光試薬用のフィルターセット、フィルターのエキサイタとエミッタのバンド幅は後の表に掲載されています。
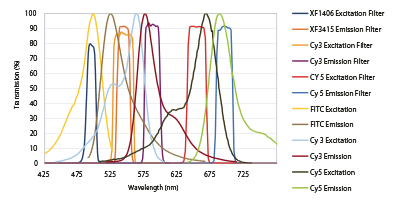 Flgure 9
Flgure 9
備考:各蛍光試薬に対するシングルエキサイタとトリプルバンドのダイクロイックとエミッタを使うXF467-1以外はすべてシングル蛍光試薬のフィルターセットです。このセットアップはマルチバンドのダイクロイックとエミッタは顕微鏡のタレットに固定され、外部フィルタースライダまたはホイールでエキサイタのみを動かすので、レジストレーションシフトとステージの動きを最小化します。
結論
蛍光顕微鏡のパワー改善と自動デジタルイメージングによ り、FISHとmFISHテクニックはさらにパワフルさを増し、基礎研究から、胎児疾患検出、がん研究、病理学、細胞遺伝学まで、生物学の多くの分野へ大きな利益をもたらしています。
蛍光顕微鏡では、プローブ検出のために正しいフィルターを特定するためにサンプルとシステムコンポーネントを注意深く検討することが必要です。静止タレット内で外部スライダやホイールにエキサイタ 一枚、そしてマルチバンドダイクロイックやエミッタを使うことでレジストレーションシフトなしでほぼ同時にプローブ検出できますが、全体の明るさ、色バランスをとる難しさ、カラーCCDカメラの分解能の減少の点で妥協を強いられます。感度、光学分解能、最小限のフォトブリーチングが重要な場合は、死狭帯域のシングルバンドフィルターセットと白黒CCDカメラでの検出が最適の選択肢です。画像レジストレーションシフトは研磨ガラス材を使うことで、最近では最小化されています。
蛍光プローブのタイプや数もフィルターの最適化には重要です。十分な光学分離でプローブ数が少ない場合は、広帯域バンドパスフィルターセットを使うことができます。5、6種類のプローブが使われるような場合は、それぞれの蛍光試薬に特定した狭帯域バンドフィルターセットを使い光学ブリードスルーを軽減する必要があります。
蛍光顕微鏡でのFISHとmFISHの方法論は進化しており、同様に試料に含まれる情報を解くために使われるソフトウエアとハードウエアもうそうあるべきです。フィルター、蛍光試薬、画像ハードウエアとソフトウエアの適切な組み合わせが正確な画像獲得と分析に必要な分解能とコントラストに必要です。

